 Szukając naukowych badań związanych z działaniem i poziomem witaminy D3 na blokowanie rozwoju choroby Covid19, znalazłem ciekawe opracowanie, które zamieszczam poniżej, zamieszczone na stronie Cambridge Uniwersity. Badania naukowców, szczególnie z Chin wykazały że ARS, czyli niewydolność oddechowa wywołana przez wirusa SARS-CoV2 ma związek z burzą cytokin i stresem oksydacyjnym o rzadko spotykanym nasileniu. Okazuje się że właśnie witamina D3, a właściwie jej poziom w organiźmie decyduje o rozwoju Covid19 w kierunku rozwoju ARS, lub bezobjawowego przejścia choroby z najczęstrzym nabyciem odporności.
Szukając naukowych badań związanych z działaniem i poziomem witaminy D3 na blokowanie rozwoju choroby Covid19, znalazłem ciekawe opracowanie, które zamieszczam poniżej, zamieszczone na stronie Cambridge Uniwersity. Badania naukowców, szczególnie z Chin wykazały że ARS, czyli niewydolność oddechowa wywołana przez wirusa SARS-CoV2 ma związek z burzą cytokin i stresem oksydacyjnym o rzadko spotykanym nasileniu. Okazuje się że właśnie witamina D3, a właściwie jej poziom w organiźmie decyduje o rozwoju Covid19 w kierunku rozwoju ARS, lub bezobjawowego przejścia choroby z najczęstrzym nabyciem odporności. Badania te potwierdzają tezę, że poziom witaminy D3 powyżej 20-25 ng/ml "zabezpiecza" przed wystąpieniem ARS , blokując wzrost ilości prozapalnych cytokin, które są charakterystycznym objawem powikłań zarażenia SARS-Cov2 (tzw. burza cytokin). Zadbanie o wysoki poziom witaminy D3 potraktować możemy więc jako swoiste zabezpieczenie przed rozwojem obecnej "pandemii" tak jak zastosowanie dużych dawek antyoksydantów (askorbinian sodu, melatonina) jako aktywnych suplementów wspierających silnie organizm, gdy wystąpią już niekorzystne działania koronawirusa.
źródło: Publikacja internetowa opublikowana przez Cambridge University Press: 10 lutego 2014 r
Wprowadzenie
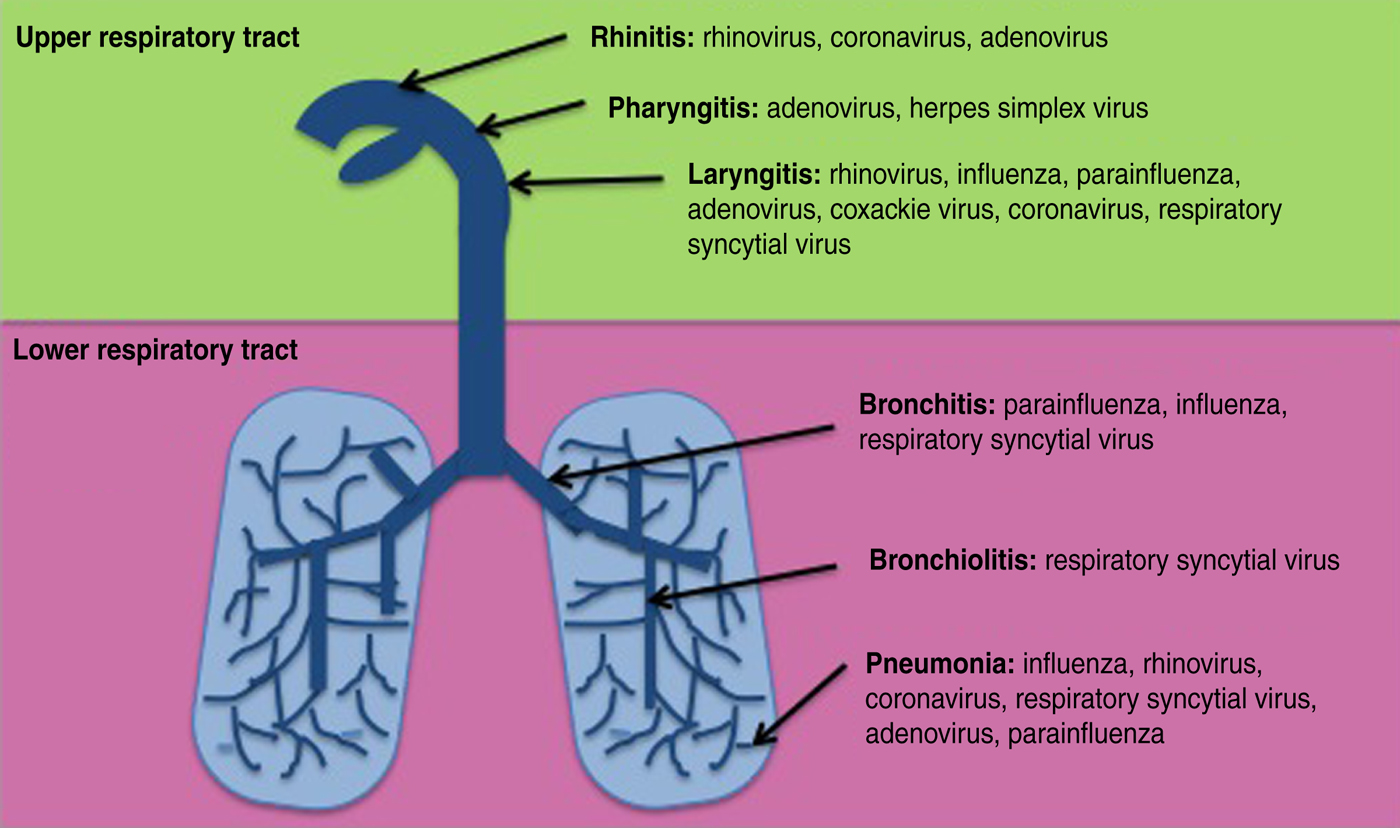
Wiadomo, że wiele różnych wirusów infekuje drogi oddechowe ( ryc. 1 ). Ogólnie rzecz biorąc, ciężka choroba ogranicza się do infekcji dolnych dróg oddechowych (LRT), prowadzących do zapalenia oskrzelików i płuc. Takie infekcje są główną przyczyną hospitalizacji i zgonów niemowląt i małych dzieci, szczególnie w krajach rozwiniętych [ 1 ], oraz poważnych chorób i śmierci osób w wieku> 65 lat w krajach uprzemysłowionych. Na przykład infekcje syncytialnym wirusem oddechowym (RSV) spowodowały hospitalizację 3,4 mln małych dzieci, przy czym na całym świecie w 2005 r. Zginęło około 133 000 [ 2 ]. Wirus grypy zainfekował 90 milionów i spowodował około 70 000 zgonów w tej samej grupie wiekowej w 2008 roku [ 3]. Według danych Światowej Organizacji Zdrowia (WHO) wśród osób starszych w USA każdego roku dochodzi do około 100 000 zgonów z powodu RSV i 36 000 z powodu grypy. Wirusowe infekcje dróg oddechowych stanowią nie tylko znaczące globalne obciążenie zdrowotne, ale także znaczne obciążenie finansowe z powodu kosztów opieki zdrowotnej i straconych dni pracy. WHO oszacowała, że w USA z powodu przeziębienia tracone są 23 miliony dni roboczych rocznie.
Rys. 1 [ kolor online ]. Częste infekcje wirusowe dróg oddechowych.
Wybuchy wirusowych infekcji dróg oddechowych, na przykład grypy A [ 4 ] i RSV [ 5 ], są od dawna związane ze zmieniającymi się porami roku, osiągając szczyt w miesiącach zimowych i nadir w miesiącach letnich. Zaproponowano różne czynniki wyjaśniające ten wzorzec, w tym zwiększoną przeżywalność i przenoszenie wirusów w niskiej temperaturze i wilgotności, zimne suche powietrze redukujące śluz w drogach nosowych oraz tendencję do gromadzenia się w pomieszczeniach w miesiącach zimowych [ 4 ], chociaż gromadzą się ludzie występuje przez cały rok, a transport publiczny, szkoły i miejsca pracy mogą stwarzać duże możliwości przenoszenia wirusa.
Ponad 30 lat temu Hope-Simpson napisał:
sama szerokość geograficzna w dużej mierze determinuje czas epidemii [infekcji dróg oddechowych] w cyklu rocznym, zależność, która sugeruje raczej bezpośredni wpływ pozytywnego lub negatywnego wpływu promieniowania słonecznego na wirusa, żywiciela ludzkiego lub ich interakcję [ 6 ].
Dlatego słoneczne promieniowanie ultrafioletowe (UV) może wpływać na sezonowość infekcji dróg oddechowych na większości szerokości geograficznych, zapewniając największą ochronę w miesiącach letnich, kiedy UVB (280–315 nm) w świetle słonecznym osiąga maksimum. W tropikach, gdzie występują niewielkie wahania słonecznego promieniowania UVB, sezonowość infekcji wirusowych dróg oddechowych jest osłabiona [ 4 , 5 ], a grypa występuje częściej w porze deszczowej, kiedy światło słoneczne jest osłabiane przez chmury i deszcz [ 5]]. Ponieważ witamina D jest wytwarzana po ekspozycji skóry na słoneczne promieniowanie UVB, osoby żyjące na średnich i dużych szerokościach geograficznych często mają niższy poziom witaminy D zimą w porównaniu z latem, z powodu braku promieniowania UVB w miesiącach zimowych. Sezonowe wahania poziomu witaminy D mają zatem odwrotną korelację z sezonowością wielu wirusowych infekcji dróg oddechowych. Odnotowano, że aktywność rozbłysków słonecznych wpływa na częstość chorób układu oddechowego, z większą liczbą zgłoszonych przypadków po rozbłyskach słonecznych [ 7]. Takie rozbłyski zwiększają poziom ozonu atmosferycznego, a tym samym zmniejszają promieniowanie UVB docierające do powierzchni ziemi, a tym samym wytwarzanie witaminy D w ludzkiej skórze jest mniejsze. Dlatego zaproponowano ochronną rolę witaminy D w określaniu podatności na wirusowe infekcje dróg oddechowych, dostarczając intrygującego wyjaśnienia sezonowości wirusowych infekcji dróg oddechowych, jak również oferując potencjalną profilaktykę zmniejszania globalnego obciążenia tymi chorobami.
W tym przeglądzie opisano mechanizmy odpornościowe, przez które witamina D może wpływać na odpowiedź organizmu gospodarza, oraz dowody z badań obserwacyjnych i klinicznych omówionych w odniesieniu do witaminy D i wirusowych infekcji dróg oddechowych. Badany jest również potencjał witaminy D w poprawie skuteczności szczepień przeciwko niektórym wirusom układu oddechowego.
Witamina D
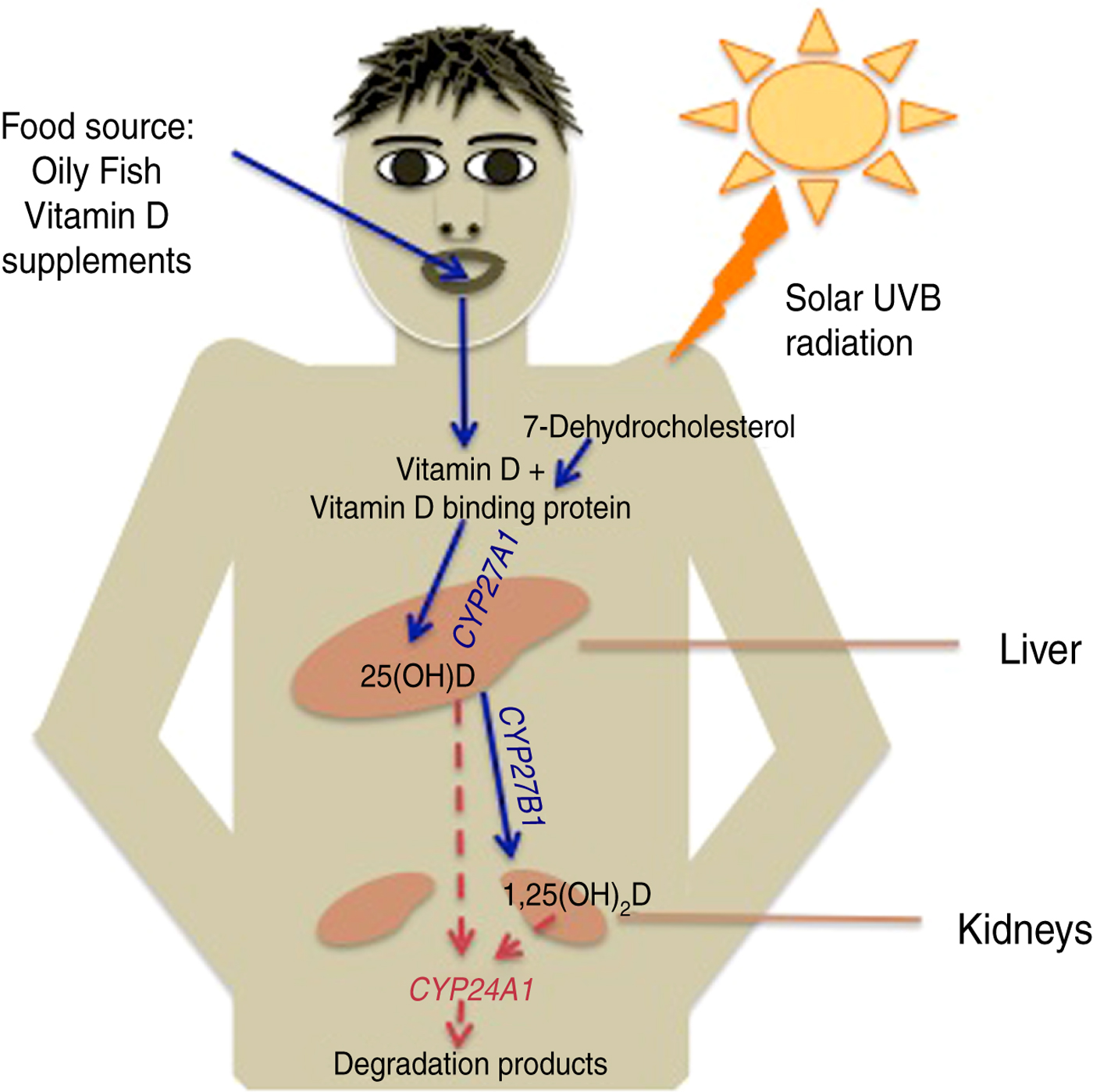
Większość witaminy D u większości osób jest wytwarzana w wyniku ekspozycji skóry na składnik UVB światła słonecznego (280–315 nm). 7-dehydrocholesterol w błonach skórnych keratynocytów jest przekształcany w szeregu etapów do 25-hydroksywitaminy D 3 [25 (OH) D 3 , kalcydiol], a następnie do aktywnej postaci witaminy D, 1,25-dihydroksywitaminy D 3 [ 1,25 (OH) 2 D 3 , kalcytriol] [ 8 ] ( ryc. 2 ). W działaniu 1,25 (OH) 2 D 3 pośredniczy ligacja z jądrowym receptorem witaminy D (VDR), w wyniku czego następuje regulacja transkrypcji co najmniej 1000 genów. 1,25 (OH) 2 D 3indukuje również szybką sygnalizację błonową przez specyficzny receptor błonowy, niedawno zidentyfikowany jako izomeraza disiarczkowa białka. Ilość krążącego 1,25 (OH) 2 D 3 jest ściśle regulowana przez kontrolę ujemnego sprzężenia zwrotnego poprzez indukcję przez hormon 24-hydroksylazy, który katabolizuje zarówno 25 (OH) D 3, jak i 1,25 (OH) 2 D 3 do różnych produkty kwasu kalcytronowego.
Rys. 2 [ kolor online ]. Synteza 25-hydroksywitaminy D [25 (OH) D] i 1,25-dihydroksywitaminy D [1,25 (OH) 2 D] po promieniowaniu słonecznym UVB lub spożyciu witaminy D.
Polecamy do stosowania wersję w postaci olejku, dawkowanego w postaci kropel. Jedna kropla to równowartość ok. 2000 jednostek, a wiec dokładnie tle ile zalecana dawka zachowawcza dzienna. W przypadkach bardziej wymagających można w prosty sposób dawkę zwiększyć, ale pamiętajmy o konsultacji z lekarzem. Normy te zostały w ostatnich czasach mocno ograniczone. Pamiętajmy też o witaminie K2 MK7 wspierającej działanie witaminy D3 i wspierającej jej działanie. Jeśli z przyczyn zdrowotnych chcielibyśmy zastosować większe dawki witaminy D3, nie powinniśmy stosować zestawów witamin D3 i K2, ponieważ witaminy K2 nie powinniśmy stosować w większych dawkach niż to jest zalecane. Dlatego w takich wypadkach lepiej stosować witaminę D3 osobno i witaminę K2 też osobno.
Witamina D zawarta w diecie, w postaci D 2 lub D 3 , zwykle w niewielkim stopniu przyczynia się do całkowitego zapotrzebowania na witaminę D i jest wchłaniana z przewodu pokarmowego do krążenia. Witamina D znajduje się w tłustych rybach, żółtku jaja i napromieniowanej żywności, takiej jak grzyby, a jej najwyższy poziom występuje w oleju z wątroby dorsza. Ograniczona liczba popularnych produktów spożywczych jest również wzmocniona witaminą D. Alternatywne źródło witaminy D 2 lub D 3 stanowią suplementy witaminowe . Donoszono, że spożycie 10 000 IU witaminy D 3odpowiada ekspozycji całego ciała na promieniowanie UV, w dawce wystarczającej do wywołania wyczuwalnego rumienia. Jest mało prawdopodobne, aby takie oszacowanie było dokładne w naturalnych warunkach zewnętrznych, a ostatnio podjęto wysiłki w celu skonstruowania modeli, które zapewniają lepsze zrozumienie tego, ile ekspozycji na słońce potrzebuje dana osoba w różnych warunkach klimatycznych, aby uzyskać określony stan witaminy D [ 9 , 10 ].
UVB stanowi najwyżej około 6% światła słonecznego z otoczenia. Odsetek ten zależy od wielu czynników zewnętrznych, w tym szerokości geograficznej, pory roku, pory dnia, wysokości, ozonu, zachmurzenia, zanieczyszczenia powietrza i powierzchni odbijających światło. Na szerokościach geograficznych powyżej 45 ° (Londyn ma 51 ° N) zasadniczo nie ma promieniowania UVB docierającego do powierzchni ziemi w miesiącach zimowych ze względu na zmniejszony kąt zenitu słonecznego. Może to spowodować obniżenie poziomu witaminy D, który wiosną zaczyna się regenerować. Na przykład w USA szczyt poziomu witaminy D występuje w sierpniu, a najniższy w lutym, z opóźnieniem wynoszącym 8 tygodni odpowiednio po szczycie i dołku, w otaczającym UVB [ 11]. Czynniki osobiste są również ważne w określaniu produkcji witaminy D z promieniowania słonecznego UVB, takie jak rodzaj skóry, wiek, ilość noszonej odzieży i nakrycia głowy, stosowanie kremów przeciwsłonecznych, wskaźnik masy ciała, stężenie cholesterolu w surowicy, polimorfizmy w VDR i enzymy szlak metaboliczny witaminy D i wyjściowy poziom 25 (OH) D. Na przykład, aby wyprodukować taką samą ilość pre-witaminy D 3 , potrzebna jest około sześciokrotnie wyższa dawka promieniowania UVB dla skóry czarnej w porównaniu z cerą jasną, ze względu na wchłanianie przez melaninę, a dla 80- lat w porównaniu do 20-latka, ze względu na redukcję 7-dehydrocholesterolu w starszej skórze.
Stan witaminy D u pacjenta jest zwykle określany na podstawie stężenia 25 (OH) D w surowicy lub osoczu, ale należy wziąć pod uwagę szereg zastrzeżeń. W wielu badaniach oceniana jest tylko jedna próbka na osobę, często bez uwzględnienia pory roku, historii przebywania na słońcu, miejsca zamieszkania i innych czynników środowiskowych i osobistych. Test 25 (OH) D jest znany z braku dokładności, powtarzalności i czułości [ 12], chociaż powinno to ulec poprawie wraz z niedawnym wdrożeniem programu standaryzacji witaminy D przy użyciu chromatografii cieczowej z tandemową spektroskopią mas (LC-MS / MS). Nie ma również zgody co do tego, jakie stężenie 25 (OH) D jest „zadowalające”. Chociaż uważa się, że poziom co najmniej 10 ng / ml 25 (OH) D jest konieczny do promowania mineralizacji kości i homeostazy wapnia, ten punkt końcowy nie jest zgodny między badaniami [ 13 ]. Zakres od 20 ng / ml (50 nmol / l) do 50 ng / ml może najlepiej zapewnić immunomodulujące działanie witaminy D [ 14 ], podczas gdy stężenia> 100 ng / ml mogą być szkodliwe, chociaż toksyczność występuje rzadko poniżej 200 ng / ml. ml [ 15 ].
Odpowiedzi immunologiczne na infekcję wirusową dróg oddechowych
Po wejściu do dróg oddechowych i zakażeniu głównie komórek nabłonka, wirusy wywołują wrodzoną odpowiedź immunologiczną, w tym odpowiedź zapalną. Neutrofile dostają się do miąższu płuc w ciągu kilku godzin od zakażenia, a następnie do monocytów / makrofagów, komórek NK, a następnie komórek T w ciągu kilku dni od zakażenia. Szczyt nacieku limfocytów T występuje 7 dni po zakażeniu, korelując z klirensem wirusa z płuc. Przeciwciała neutralizujące są również obecne około 7 dni po zakażeniu i są utrzymywane u żywiciela jako pierwsza linia obrony przed ponownym zakażeniem.
Wrodzone komórki odpornościowe wywołują wczesną odpowiedź przeciwwirusową po rozpoznaniu patogenu przez receptory rozpoznające wzorce, w tym receptory Toll-like (TLR) i receptory RIG-like [ 16 ]. Zaangażowanie tych receptorów indukuje kaskady sygnalizacyjne, które generują interferon typu I (IFN) i cytokiny prozapalne. Cząsteczki te kontrolują infekcję poprzez mechanizmy rozszczepiania wirusa i hamowania fuzji wirusów, replikacji i translacji, aktywując komórki cytolityczne i stymulując czynniki humoralne, w tym białka ostrej fazy, defensyny, kolektyny i białka dopełniacza. Jednakże, ponieważ odpowiedzi te mogą prowadzić do immunopatologii płuc [ 17 ], pośredniczącej w chorobowości i śmiertelności wirusowych infekcji dróg oddechowych, wymagają one regulacji immunologicznej.
Adaptacyjna odpowiedź immunologiczna jest również odpowiedzialna za powrót do zdrowia po wirusowej infekcji dróg oddechowych. Komórki prezentujące antygeny, w tym makrofagi i komórki dendrytyczne, przetwarzają i prezentują antygeny wirusa limfocytom T CD4 + i CD8 + w drenującym węźle chłonnym. Następnie limfocyty T migrują i gromadzą się w zakażonej tkance, pośrednicząc w efektach cytolitycznych i prozapalnych. Komórki pomocnicze CD4 + T odgrywają kluczową rolę: promują odpowiedź limfocytów B, w tym proliferację, różnicowanie do komórek plazmatycznych, zmianę klasy immunoglobulin w celu wytworzenia przeciwciał IgG i IgA, dojrzewanie powinowactwa i indukcję komórek B pamięci, a także promują cytolityczne odpowiedzi komórek T CD8 + [ 16]. Przeciwciała wytwarzane przez komórki B mogą zapobiegać przenikaniu wirusa do komórek i promować fagocytozę wirusa przez wrodzone komórki odpornościowe. IgA jest szczególnie ważna w blokowaniu przenoszenia wirusa między gospodarzami.
Zatem wrodzone i adaptacyjne odpowiedzi immunologiczne odgrywają współzależną rolę w ochronie przed wirusowymi infekcjami dróg oddechowych.
Modulacja wrodzonej odpowiedzi immunologicznej na wirusowe infekcje dróg oddechowych przez witaminę D.
VDR jest szeroko wyrażany na komórkach układu odpornościowego i komórkach nabłonka [ 18 ], przy czym polimorfizm pojedynczego nukleotydu w VDR koreluje z ryzykiem zakażenia RSV [ 19 ]. 1,25 (OH) 2 D pobudza neutrofile, makrofagi i komórki NK dróg oddechowych, a także komórki nabłonka do produkcji peptydów przeciwdrobnoustrojowych (AMP), w tym defensyn i katelicydyny [ 20 ]. Te AMP mają działanie przeciwwirusowe z hCAP18 / LL-37, w szczególności mające działanie przeciw grypie [ 21 ].
1,25 (OH) 2 D wpływa również na wrodzoną odpowiedź immunologiczną, zwiększając ekspresję TLR i CD14 [ 20 ], dojrzewanie makrofagów i zdolność do wybuchu oksydacyjnego [ 22 ]. Dlatego wzmacnia aktywność przeciwbakteryjną makrofagów. Znaczenie makrofagów i neutrofili podczas początkowej interakcji wirusa z żywicielem wykazano u myszy poprzez zwiększenie nasilenia choroby po wyczerpaniu tych komórek przed zakażeniem grypą [ 23 ]. Jednak pomimo wzmożonej aktywności makrofagów autofagia ulega zmniejszeniu podczas infekcji [ 24]. Autofagia, ważny proces w homeostazie komórkowej, odgrywa rolę w indukcji cytokin. W zakażeniu wirusem grypy A autofagia jest związana z produkcją IFN- α i CXCL10 oraz ze zwiększoną replikacją wirusa [ 25 ]. Zatem hamowanie autofagii przez witaminę D może być kolejnym mechanizmem kontroli infekcji wirusowych dróg oddechowych, oprócz kontrolowania patologii w płucach. Wpływ witaminy D na wrodzoną odpowiedź immunologiczną obejmuje również promowanie migracji mieloidalnych komórek dendrytycznych do narządów limfoidalnych odległych od drenujących węzłów chłonnych, gdzie aktywują specyficzne dla antygenu limfocyty T i B CD4 + [ 26 , 27 ].
Witamina D hamuje produkcję cytokin prozapalnych. Podczas zakażenia grypą A IFN- β , czynnik martwicy nowotworu (TNF) - α , interleukina (IL) -8, IL-6 i RANTES są zmniejszone w komórkach nabłonka płuc w odpowiedzi na leczenie 1,25 (OH) 2 D [ 24 ]. Podczas infekcji RSV komórek nabłonka dróg oddechowych witamina D indukuje I κ B α , hamując w ten sposób odpowiedzi NF κ B [ 28 ]. Chociaż takie efekty mogą wydawać się odwrotne do zamierzonych w indukcji skutecznych odpowiedzi wirusowych przeciw oddychaniu gospodarza, uznaje się, że patogeniczność wirusów układu oddechowego jest związana z hipercytokinemią [ 29], nazywany również burzą cytokin, która jest potencjalnie śmiertelnym, samonapędzającym się cyklem odpowiedzi zapalnej. W szczególności zakażenie bardziej patogennymi szczepami grypy powoduje zwiększoną replikację wirusa, naciekanie neutrofili oraz poziomy cytokin i chemokin w porównaniu z mniej patogennymi szczepami [ 23 ]. Zatem kontrolowanie odpowiedzi prozapalnych jest korzystne dla gospodarza narażonego na wirusy układu oddechowego. Na poparcie wykazano, że poziomy IL-1 β , IL-6, TNF- α , IFN- γ i IL-10 są tłumione podczas stymulacji TLR ludzkich jednojądrzastych komórek krwi obwodowej w miesiącach letnich, kiedy zakażenia wirusami dróg oddechowych są najniższe w porównaniu z odpowiedziami zimą [ 26].
Modulacja adaptacyjnej odpowiedzi immunologicznej na wirusowe infekcje dróg oddechowych przez witaminę D.
Intrygujące immunomodulujące działanie witaminy D obejmuje adaptacyjną odpowiedź immunologiczną, zwłaszcza limfocyty T. 1,25 (OH) 2 D zwrotnego hamowania indukcji zarówno komórek T pomocniczych (Th), 1- i Th2 cytokin związanych gdy stosowane podczas aktywacji pomocniczych limfocytów T; tylko cytokiny związane z Th1 są regulowane w dół, jeśli 1,25 (OH) 2 D zostanie zastosowane po ustanowieniu aktywowanych podzbiorów komórek pomocniczych T. [ 30 ]. To hamowanie występuje na poziomie transkrypcji cytokin, a nie na jakimkolwiek wpływie na cykl komórkowy lub czynniki transkrypcyjne związane z Th1- / Th2. Limfocyty T u myszy pozbawionych VDR rozwijają się normalnie, ale nadmiernie wytwarzają prozapalne cytokiny związane z Th1- [ 31 ] i Th17 [ 32], uzasadniając w ten sposób rolę witaminy D w regulacji cytokin zapalnych.
Witamina D może również aktywować podzbiory komórek T regulatorowych (Treg). VDR wiąże się z konserwatywnym niekodującym regionem genu FoxP3 związanego z komórkami Treg i promuje ekspresję tego genu w komórkach pomocniczych T [ 33 ]. Zwiększa to liczbę komórek Treg i ich aktywność supresorową. Ponadto odnotowano zwiększoną produkcję cytokiny przeciwzapalnej IL-10 przez limfocyty T CD4 + w odpowiedzi na umiarkowane poziomy 1,25 (OH) 2 D [ 34 ]. Nawet miejscowe podanie 1,25 (OH) 2 D zapewnia wzrost supresyjnej aktywności limfocytów T CD4 + CD25 + , jak opisano w modelu astmy [ 35]. Adoptywny transfer komórek Treg do myszy z niedoborem limfocytów, które nie mogą wytworzyć adaptacyjnej odpowiedzi immunologicznej, spowodował zahamowanie wrodzonej patologii o podłożu immunologicznym podczas zakażenia grypą [ 36 ]. Myszy biorcy opóźniły utratę wagi i przedłużyły przeżycie po zakażeniu. Dlatego witamina D ma potencjał wywoływania ochronnej odpowiedzi podczas infekcji wirusowej dróg oddechowych poprzez jej wpływ na komórki Treg.
Witamina D może modulować zarówno wrodzoną, jak i adaptacyjną odpowiedź immunologiczną za pomocą opisanych powyżej mechanizmów, a polimorfizm VDR został skorelowany z podatnością na wirusowe infekcje dróg oddechowych, co sugeruje, że witamina D może stanowić cel terapeutyczny dla takich chorób. Rola witaminy D została zbadana w badaniach klinicznych, a dotychczasowe wyniki zostały opisane.
Dowody obserwacyjne łączące poziom witaminy D z ochroną przed wirusowymi infekcjami dróg oddechowych
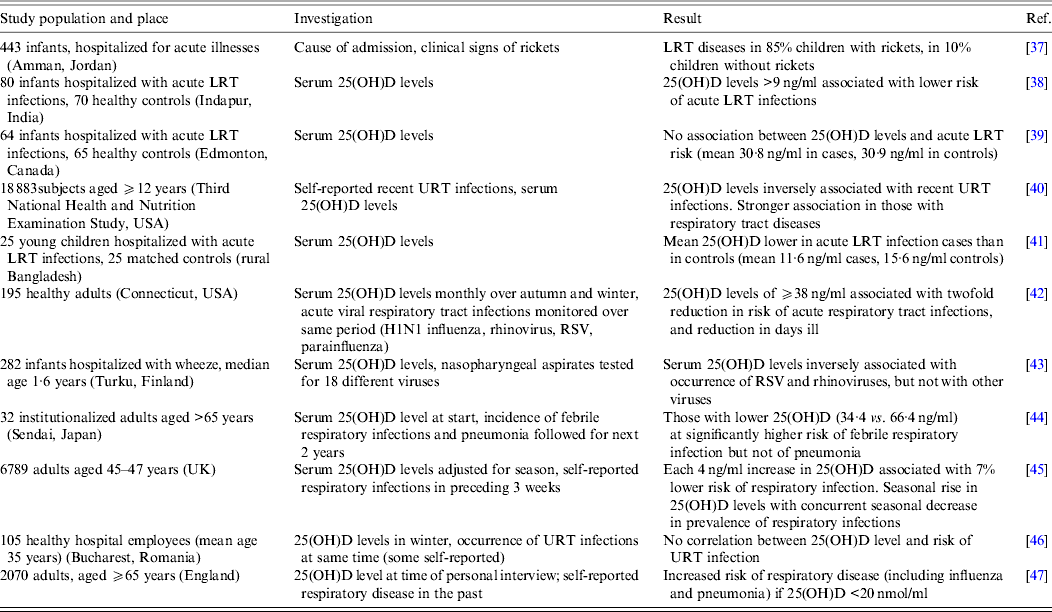
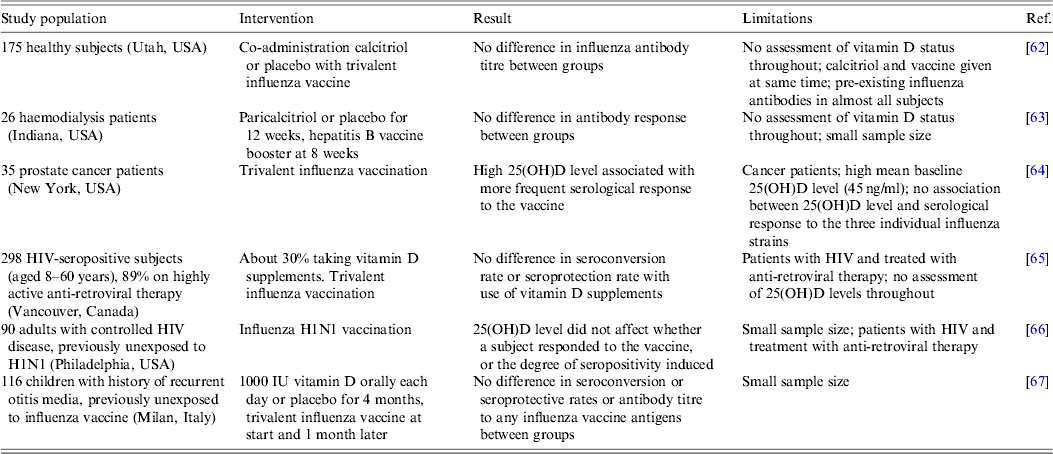
W wielu badaniach opublikowanych w ciągu ostatnich 10 lat badano korelację między stanem witaminy D, ocenianym na podstawie stężenia 25 (OH) D w surowicy, a występowaniem wirusowych infekcji dróg oddechowych. Wybór tych publikacji przedstawiono w tabeli 1. Badania przeprowadzono w różnych krajach i środowiskach, przy czym liczba przedmiotów wahała się od mniej niż 50 do wielu tysięcy. W większości przypadków im niższe stężenie 25 (OH) D, tym większe ryzyko infekcji wirusowych dróg oddechowych. Jednak w większości przypadków badana populacja miała już objawy infekcji w momencie pomiaru 25 (OH) D. Dlatego nie można rozróżnić, czy niski poziom witaminy D jest czynnikiem przyczyniającym się do infekcji, czy też konsekwencją. Rzeczywiście, w jednym badaniu z udziałem dużej liczby osób stwierdzono, że zmniejszenie ryzyka infekcji poprzedzało wzrost poziomu 25 (OH) D [ 45]. Ponadto infekcje rzadko rozpoznawano na podstawie testów laboratoryjnych, ale subiektywnie na podstawie raportów własnych lub rodziców lub na podstawie objawów klinicznych, co uniemożliwiło przypisanie jakiegokolwiek wpływu poziomu witaminy D konkretnie patogenowi wirusowemu. Wreszcie, żadne badania nie analizowały możliwości, że same infekcje mogą mieć wpływ na katabolizm 25 (OH) D i 1,25 (OH) 2 D, powodując pozorny niedobór witaminy D.
Tabela 1. Badania obserwacyjne łączące poziom witaminy D z ryzykiem infekcji wirusowych dróg oddechowych
LRT, dolne drogi oddechowe; RSV, syncytialny wirus oddechowy; URT, górne drogi oddechowe; 25 (OH) D, 25-hydroksywitamina D.
Badano również, czy poziom witaminy D u matki może wpływać na ryzyko infekcji wirusowej układu oddechowego u dziecka. Karatekin i in. [ 48 ] stwierdzili, że poziomy 25 (OH) D w surowicy były niższe u noworodków hospitalizowanych z powodu ostrych zakażeń LRT i ich matek niż u zdrowych noworodków i ich matek. Zarówno Camargo i wsp. [ 49 ] w Nowej Zelandii oraz Belderbos i in . [ 50] w Holandii monitorowali 25 (OH) D we krwi pępowinowej i powiązali to prospektywnie z występowaniem infekcji dróg oddechowych u dziecka. W poprzednim badaniu u 882 noworodków z <10 ng / ml 25 (OH) D we krwi pępowinowej prawdopodobieństwo wystąpienia infekcji dróg oddechowych (według doniesień matek) było dwukrotnie większe w porównaniu z noworodkami z <30 ng / ml. . W tym ostatnim badaniu 156 noworodków z <20 ng / ml 25 (OH) D we krwi pępowinowej było sześciokrotnie bardziej narażone na infekcję LRT (jak donosi matka i obecność RSV-RNA w wymazach z nosa i gardła) ) w pierwszym roku życia w porównaniu z osobami z> 30 ng / ml 25 (OH) D. Ponadto wieloośrodkowe badanie z siedzibą w Hiszpanii wykazało, że potomstwo matek, u których poziom 25 (OH) D znajdował się w najwyższym kwartylu,51 ]. Odkrycia te pokazują, że niski poziom witaminy D u matki może niekorzystnie wpływać na rozwój układu odpornościowego płodu, prawdopodobnie prowadząc do mniej skutecznej odpowiedzi przeciwwirusowej po urodzeniu. Ponadto, jeśli zawartość witaminy D w mleku matki jest niska, spowoduje to niewystarczający poziom witaminy D u dziecka podczas karmienia piersią. Alternatywnie wyższy poziom witaminy D u matki może oznaczać większą ekspozycję na słońce, co może mieć pozytywne skutki niezależne od produkcji witaminy D. Wyraźnie ważne jest monitorowanie poziomu 25 (OH) D u dzieci we wczesnym okresie życia w celu wyjaśnienia tych możliwości i sformułowania świadomych zaleceń dotyczących suplementacji witaminy D w czasie ciąży i w pierwszych miesiącach po urodzeniu.
Badania kliniczne suplementów diety witaminy D i ochrony przed wirusowymi infekcjami dróg oddechowych
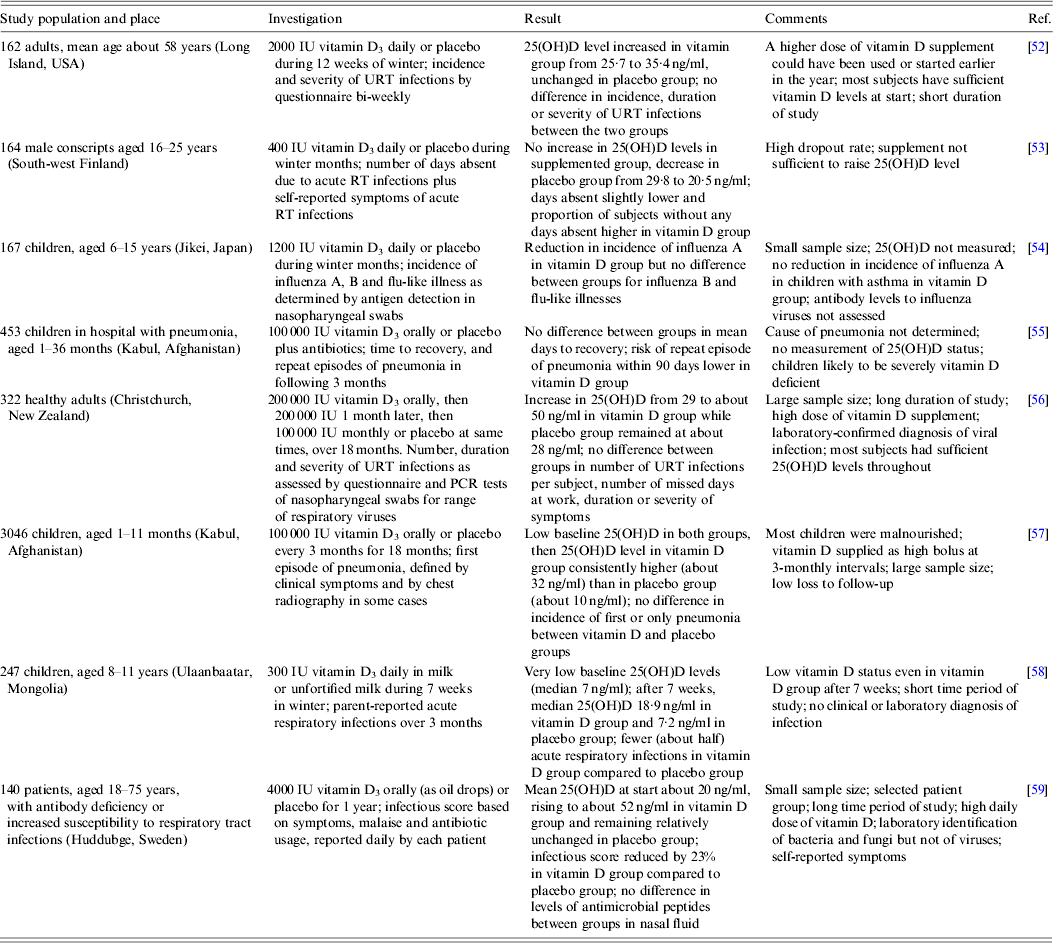
Podczas gdy badania łączące poziomy 25 (OH) D z ryzykiem infekcji wirusowych dróg oddechowych zostały opisane powyżej, w tej części omówiono badania kliniczne dotyczące suplementacji witaminy D 3 w profilaktyce infekcji dróg oddechowych. Osiem takich badań podsumowano w tabeli 2 . Podobnie jak w przypadku badań obserwacyjnych ( tabela 1 ), raporty te obejmują szeroki zakres osób, w niektórych przypadkach z podstawowymi problemami zdrowotnymi, mieszkających w różnych częściach świata, którym podawano witaminę D 3.suplementy w różnych dawkach i częstotliwościach w różnych okresach czasu. Występowały również znaczne różnice w mierzonych punktach końcowych, przy czym objawy zgłaszane przez pacjentów były częste, a identyfikacja laboratoryjna określonych czynników zakaźnych - rzadko. Krótko mówiąc, nie stwierdzono stałej różnicy w ryzyku zakażenia wirusem dróg oddechowych między osobami, którym podano suplement, a tymi, którym podano placebo. Były jednak pewne dowody, takie jak opisane przez Camargo i wsp . [ 58], że suplement może mieć działanie ochronne u niektórych osób z niskim wyjściowym poziomem witaminy D. Może to wskazywać, że podwyższenie poziomu 25 (OH) D z niedoboru aktywuje różne wrodzone i adaptacyjne odpowiedzi immunologiczne, które są krytyczne w zwalczaniu niektórych wirusowych infekcji dróg oddechowych, podczas gdy, przeciwnie, wzmocnienie z wyższego początkowego poziomu 25 (OH) D nie zapewnia żadnych dodatkowych korzyści.
Tabela 2. Prospektywne, randomizowane, podwójnie zaślepione badania dotyczące suplementacji witaminy D i ochrony przed wirusowymi infekcjami dróg oddechowych
RT, drogi oddechowe; URT, górne drogi oddechowe; 25 (OH) D, 25-hydroksywitamina D.
Nowatorskie podejście polegało na poddaniu grupy młodych dorosłych opalania pod rumieńem trzy razy w tygodniu w okresie zimowym, podczas gdy inna grupa przyjmowała codziennie suplementy witaminy D (1000 IU), a grupa kontrolna nie miała interwencji [ 60 ]. Poziom 25 (OH) D w surowicy spadł w grupie kontrolnej, ale wzrósł w pozostałych dwóch grupach. Nie różnił się jednak odsetek osób w każdej grupie, u których wystąpiło zgłaszane samodzielnie zakażenie górnych dróg oddechowych. W związku z tym stwierdzono, że ani ekspozycja na promieniowanie UVB, ani suplementy witaminy D nie zmniejszały ryzyka takiej infekcji.
Witamina D a skuteczność szczepień
Jak omówiono powyżej, 1,25 (OH) 2 D 3 ma zdolność wywoływania niektórych przeciwwirusowych odpowiedzi immunologicznych i dlatego może potencjalnie poprawiać skuteczność szczepienia, na przykład poprzez aktywację makrofagów, chemotaksję monocytów i migrację szpiku komórki dendrytyczne z miejsca szczepienia skórnego do wielu narządów limfatycznych, gdzie stymulują specyficzne dla antygenu odpowiedzi limfocytów T i B [ 27 ]. Eksperymenty na dorosłych myszach wykazały, że jednoczesne podawanie 1,25 (OH) 2 D 3 z inaktywowanym wirusem grypy wzmocniło zarówno odpowiedź przeciwciał przeciwko wirusowej hemaglutyninie, jak i odporność śluzówki [ 61]. Podejście to zostało do tej pory przetestowane w ograniczonej liczbie badań na ludziach, których szczegóły przedstawiono w tabeli 3 . W niektórych przypadkach oceniano poziom 25 (OH) D u badanych, aw innych w kontrolowanych badaniach podawano suplementy witaminy D. Ogólnie rzecz biorąc, wyniki wskazywały, że ani o indukcji seropozytywności, ani o jej stopniu nie decydował poziom witaminy D lub przyjmowanie suplementów witaminy D, chociaż należy zauważyć, że we wszystkich przypadkach liczba badanych była mała i często nie zdrowy. Oceniano również odporność surowicy, a nie śluzówki, przy czym ta ostatnia miała większe znaczenie w początkowej interakcji między wirusem układu oddechowego a gospodarzem.
Tabela 3. Podsumowanie badań dotyczących poziomu witaminy D w skuteczności szczepień
Wnioski
Oczywiste jest, że 1,25 (OH) 2D ma wiele właściwości immunomodulujących, które mogą potencjalnie zmniejszyć ryzyko objawowej infekcji wirusowej układu oddechowego. Większość badań obserwacyjnych wskazuje, że niski poziom 25 (OH) D zwiększa ryzyko infekcji wirusowych dróg oddechowych, ale w większości przypadków nie było możliwe określenie czasu zakażenia w odniesieniu do poziomu witaminy D u osobnika. . W dotychczasowych prospektywnych badaniach klinicznych prawie wszystkie nie wykazały jednoznacznie, że suplementy witaminy D wpływają na ryzyko infekcji wirusowych układu oddechowego. Jednak tam, gdzie początkowe poziomy 25 (OH) D były bardzo niskie, istniały pewne oznaki ochronnego działania suplementów. Ograniczone badania przeprowadzone do tej pory nie wykazały generalnie, że stan witaminy D wpływa na odpowiedź immunologiczną na szczepienie.
Chociaż wiele z omawianych tu badań nie wykazuje jednoznacznej, jednoznacznej roli witaminy D w ochronie przed wirusowymi infekcjami dróg oddechowych, przyjęte podejścia dostarczają wskazówek do projektowania przyszłych badań. Dlatego należy zwrócić uwagę na stan zdrowia, stan witaminy D i wielkość próby w grupie badanej. Na przykład, jeśli poziom witaminy D w grupie jest już wystarczający, jest mało prawdopodobne, że suplementy diety będą miały jakikolwiek wpływ. Możliwe jest również, że polimorfizmy w VDR, białku wiążącym witaminę D lub enzymach hydroksylazy mogą wpływać na zdolność osobnika do reagowania na suplement witaminy D, dlatego też może być wymagane genotypowanie w celu rozróżnienia efektów podgrup. Ponadto ważne jest podanie i ilość suplementu diety - czy należy go podawać sporadycznie w dużych dawkach,68 ]. Należy ocenić długość okresu badawczego, biorąc pod uwagę sezonową zmienność poziomów 25 (OH) D na wielu szerokościach geograficznych oraz fakt, że w badanej populacji może występować niewielka częstość infekcji wirusowych dróg oddechowych. W prospektywnych badaniach na dużą skalę, które nie powinny być zakończone przez co najmniej 4 lata, dawki wahają się od 2000 IU dziennie do 100 000 (2,5 mg) IU witaminy D 3 każdego miesiąca. Potrzebne są laboratoryjne metody identyfikacji mikroorganizmów wywołujących objawy kliniczne i zbadania możliwości, że witamina D może chronić przed jednym typem wirusa, ale nie przed innym. Wreszcie jest możliwe, jak sugerowano w kilku ostatnich doniesieniach, że słoneczne promieniowanie UV może mieć korzystny wpływ na zdrowie poza produkcją witaminy D [ 69]., 70 ]
Pozostaje kuszącą, ale jak dotąd niespełnioną nadzieją, że podwyższenie poziomu witaminy D w populacji może być skuteczną i niedrogą profilaktyką szeregu infekcji wirusowych układu oddechowego, szczególnie u osób najbardziej narażonych na ciężkie objawy, takich jak małe dzieci i osoby starsze.
Podziękowanie
Dziękujemy dr Kate Templeton (Royal Infirmary of Edinburgh) za krytyczną recenzję ryciny 1 .
Deklaracja zainteresowania
Żaden.
Bibliografia
Nowy materiał potwierdzający skuteczne działanie witamniny D3 na proces odporności na powikłania występujące przy Covid-19. Pan profesor nie zna przyczyny tego typu działania witaminy D3, ale zauważył zbieżność bezpiecznego poziomu tej witamniny i braku groźnych powikłań .